Uma possível ferramenta genética contra o câncer: o RNA de interferência.
Que o câncer é um problema sério de saúde pública e vem há muitos anos tirando o sono de milhares de pessoas que sofrem deste mal e das autoridades dos setores de saúde pública, já não é novidade para ninguém. Segundo dados do Instituto Nacional do Câncer (INCA), no ano de 2012, para cada 100 mil habitantes, a incidência de novos casos de câncer foi de 268 para homens e de 260 para as mulheres, somando um total de aproximadamente 528. Além disso, houve uma previsão de ocorrência de mais 518.510 novos casos de câncer, para o ano de 2013.
Em vista desses dados, o que fazer? Atualmente, existe uma série de tecnologias para ajudar no tratamento desta doença, como intervenção cirúrgica, radioterapia, quimioterapia, terapia hormonal e imunoterapia. Cada um destes métodos vem se tornando eficaz em determinados casos, embora todos possuam algum efeito colateral no organismo. Um método, que vem sendo recentemente estudado, é a utilização de uma pequena molécula de RNA, conhecida como RNA de interferência (ou simplesmente RNAi), para bloquear genes que induzem a formação do câncer.
Antes de falarmos sobre o funcionamento deste novo mecanismo, devemos entender como funciona a produção de proteínas em uma célula. O código genético de todos os seres vivos existentes no planeta é encontrado no DNA. O DNA é uma molécula gigante (se levarmos em conta o tamanho médio de uma molécula qualquer), que é encontrada no núcleo da maioria das células do corpo de um organismo. É composta de duas cadeias de moléculas menores (nucleotídeos) que, quando juntas, dão a ela a forma de uma espiral. Ao longo de cada uma dessas cadeias, comumente chamadas de fitas, existe uma sequência dos diferentes nucleotídeos (4, no total), dispostos de forma aleatória, que conferem a cada molécula de DNA um código específico.
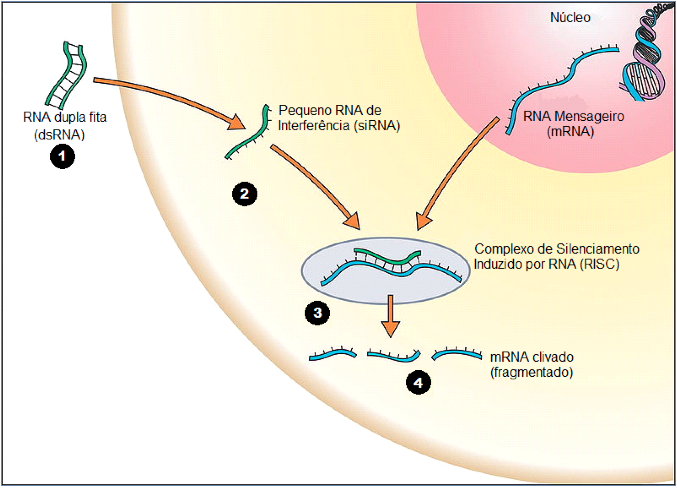 |
| http://commons.wikimedia.org/(Modificado): Esquema básico do funcionamento do RNA de Interferência (RNAi): 1- RNA de dupla fita é inserido na célula por meio de algum vetor; 2- Dentro da célula, por processos enzimáticos, a dupla fita de RNA se torna uma só; 3- O pequeno RNA de Interferência (Small Interfering RNA, ou simplesmente siRNA, em inglês) destrói o RNA mensageiro (mRNA), com a ajuda de um complexo enzimático conhecido como RISC (RNA Interfering Silencing Complex, ou Complexo de Silenciamento Induzido por RNA, em português); 4- O RNA de Interferência destrói o RNA mensageiro, ou apenas inibe a sua atividade. Desta forma, a célula não consegue expressar seus genes pela destruição de seu RNA mensageiro. |
A célula é capaz de "ler" esses códigos e passar essas informações para uma nova molécula, que é conhecida como RNA mensageiro (ou RNAm). O RNAm, ao contrário do DNA, é uma molécula de uma única fita de nucleotídeos, capaz de sair do núcleo e de levar a informação copiada do DNA para o lado de fora do núcleo (citoplasma), onde se encontram os ribossomos. Os ribossomos são componentes da célula que têm a função de "ler" novamente essa sequência (a partir do RNAm) e de traduzi-la em proteínas. Dessa forma, a célula controla a produção de suas proteínas de acordo com a necessidade delas, no momento.
Voltando ao assunto principal, o RNA de interferência é uma molécula de RNA especial, que pode ser produzida em laboratório ou pode ser obtida de células do próprio organismo. O que há de especial no RNAi é que ele, além de ter fita dupla, é capaz de bloquear a síntese de determinadas proteínas por se ligar ao RNAm e degradá-lo. Desta forma, o RNAi não deixa que o RNAm faça o seu papel junto aos ribossomos para a produção da proteína. O RNAi possui sequências específicas, que se ligam apenas a um RNAm específico, impedindo a produção específica de uma proteína. A compreensão desse mecanismo, em 1998, pelos pesquisadores norte-americanos Andrew Z. Fire e Craig C. Mello (Nature 391:806-811,1988), os levou a ganhar o Prêmio Nobel de Medicina e Fisiologia oito anos mais tarde, em 2006.
O efeito do RNAi foi notado pela primeira vez em 1990, quando pesquisadores fizeram um estudo com petúnias. Essas plantas possuem um gene responsável pela produção dos pigmentos da flor desta planta. Os pesquisadores aumentaram a atividade deste gene para que a planta ficasse com uma coloração mais forte. Entretanto, eles obtiveram justamente o contrário. As pétalas das flores ficaram com várias manchas sem pigmentos. Naquela época, ainda não se conhecia os segredos do RNAi, embora, posteriormente, tenha sido visto que a ausência dos pigmentos devia-se à participação do RNAi.
Como o RNAi pode relacionar-se com o câncer? Antes, precisamos conhecer um pouco sobre o câncer. O câncer se caracteriza por um tumor, isto é, um agrupamento desordenado de células que se multiplicam descontroladamente. Essa massa de células pode ser capaz de se espalhar para outras partes do corpo, através da circulação sanguínea. O câncer tem início quando uma célula sofre uma mutação genética (a partir do DNA) que faz com que ela produza uma certa proteína que desencadeia na célula processos de multiplicação celular sem controle. Em uma determinada fase, algumas dessas células se soltam deste tecido e são levadas para outras partes do corpo através da corrente sanguínea ou linfática, fazendo com que o tumor se espalhe, na fase conhecida comofase metastática do câncer ou metástase. A metástase é a fase mais grave da doença e o gene mutado, que induziu a formação do câncer, é conhecido como oncogene.
É justamente aí que se encaixa a ação do RNAi. Essa pequena molécula de fita dupla, de 20-25 nucleotídeos, com a ajuda de determinadas proteínas, pode ser usada para se ligar ao RNAm dos oncogenes e impedir a sua produção. Dessa forma, a célula é incapaz de produzir a proteína desencadeadora do tumor. Um trabalho, realizado pela pesquisadora Profa. Dra. Nayara Delgado André, na Faculdade de Medicina de Ribeirão Preto - USP, sob a orientação do Prof. Dr. Fernando Luiz De Lucca, mostrou que reduzir o crescimento de tumores a partir do RNAi não é uma tarefa possível. Realizado entre 2003 e 2008, este trabalho pode ser considerado como pioneiro nessa área no país, tendo sido publicado em revista internacional (Cancer Letters 258: 118-125, 2007). Os autores conseguiram produziruma molécula de RNAi que foi capaz de diminuir a atividade metastática de um tipo de tumor em camundongos de laboratório. Embora trabalhos anteriores sugeriam que um gene conhecido como PKR impedia que um tecido tumoral se desenvolvesse, os pesquisadores verificaram que ocorria o contrário em seus experimentos. Esse gene aumentava o potencial metastático de um tipo de câncer que se desenvolve em camundongos (melanoma B16-F10, um tipo de tumor maligno de tecido epitelial que coloniza seletivamente os pulmões). Produzir um RNAi que bloqueasse a ação do PKR, destruindo ou inativando o RNAm desta proteína, foi a alternativa pensada pelos pesquisadores. Cultivaram células tumorais de melanoma que expressavam o gene PKR na presença e na ausência de um RNAi específico para esse gene. Quantificaram os níveis de RNAm e de proteínas que foram produzidos por elas e compararam os dois tipos de células. Por último, algumas dessas células (tratadas ou não com o RNAi) foram implantadas nos animais, para, mais tarde, verificar o quanto esse tumor se espalhou em seus pulmões em forma de nódulos, ou seja, em forma de pequenas massas de tecido cancerígeno (metástase). Um dia depois de terem sido feitos os tratamentos nestas células, aconteceu uma redução de 82% do RNAm e de 39,4% do nível de proteínas, atingindo uma diminuição 98%, tanto do RNAm quanto de proteínas, após o segundo dia. Após 21 dias, o número de nódulos nos plumões diminuíram muito nos camundongos que receberam as células com o RNAi, em comparação com o outro.
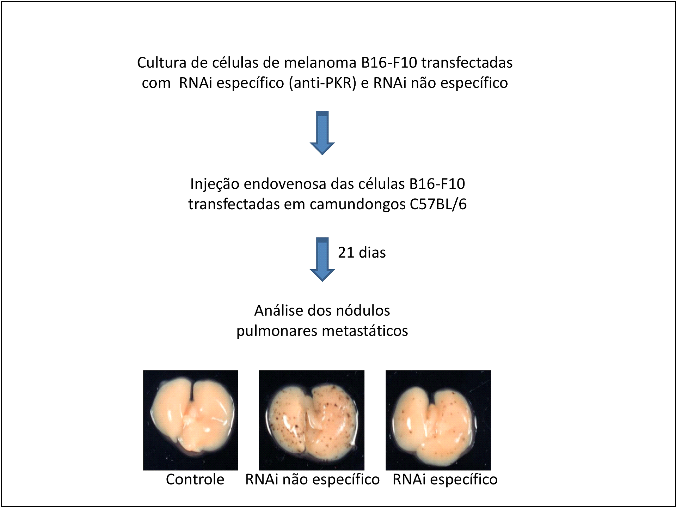 |
| Diagrama mostrando a ação do RNA de Interferência (RNAi) na redução dos nódulos pulmonares metastáticos em pulmão de camundongos. As células de um tecido cancerígeno foram tratadas com RNAi, e foram introduzidas nos animais, para verificar se estas células conseguem formar nódulos metastáticos no pulmão. Estas células só se proliferam nos pulmões destes animais, ou seja, possuem colonização seletiva. Quando foram comparadas com um pulmão não infectado (primeira imagem) e com um pulmão infectado com células do tumor que foram tratada com RNAi que não provoca o silenciamento (segunda imagem), vê-se que a ação do RNAi específico ao gene que se deseja silenciar consegue, efetivamente, reduzir estes nódulos metastáticos. |
Seria possível utilizarmos essa metodologia para a cura do câncer em humanos? Segundo a Profª. Dra. Nayara "é um grande salto usar o RNAi para silenciar o gene PKR in vivo, pois esta proteína exerce funções essenciais para a proliferação e diferenciação de células normais e seu silenciamento indiscriminado poderia levar a sérios efeitos colaterais. No entanto, acreditamos que os nossos resultados servem de alerta no sentido de investigar o papel desta proteína nas células tumorais, podendo ser usado como um dos alvos em casos de tumores sólidos, em que esta proteína esta altamente expressa e de fácil acesso à administração do RNAi, como é o caso do melanoma." E acrescenta, "o emprego do RNAi como abordagem terapêutica tem sido considerado altamente promissor no combate a doenças em que a expressão anormal de certos genes pode ser identificada como a causa ou o fator contribuinte. Entre essas doenças podemos citar, além do cancer, doenças genéticas dominantes, doenças autoimunes e infecções virais".
Aina segundo a Dra. Nayara, "nos últimos anos, o RNA de interferência tem se tornado um importante instrumento para investigação da função gênica em células de mamíferos, além de seu grande potencial terapêutico, à medida que permite o silenciamento reversível de qualquer gene de interesse. Esse grande potencial do RNAi tem resultado em estratégias bem-sucedidas para o silenciamento de uma grande variedade de genes codificadores de proteínas, permitindo obter importantes informações sobre a função desses genes e respectivas proteínas." Entretanto, há importantes limitações, segundo a pesquisadora, que diz "no caso específico do câncer, a identificação de numerosas vias de sinalização desreguladas nas células tumorais tem demonstrado uma grande quantidade de alvos potenciais, cujo silenciamento poderia resultar em benefícios significativos para o tratamento destas neoplasias, podendo-se pensar na administração de uma mistura de RNAi para diferentes genes envolvidos no desenvolvimento de um determinado tipo de neoplasia. Entretanto, apesar do cenário promissor e da grande expectativa por toda comunidade científica, existem grandes desafios no emprego desta ferramenta in vivo, as mesmas há tempos enfrentadas por pesquisadores que trabalham no campo da terapia gênica. Entre estes obstáculos estão a possibilidade dos RNAi ativar o sistema imune, causando um série de efeitos sistêmicos indesejados, comprometendo, em última análise, o seu uso clínico; a dificuldade em se administrar o RNAi apenas para as células tumorais ou determinado órgão alvo; a duração do efeito; o rápido clearance destas moléculas, ou seja, degradação e eliminação do organismo".
Em conclusão, mesmo sendo uma área de pesquisa que enfrenta grandes desafios, as perspectivas são animadoras e as pesquisas na área são crescentes. Seguramente, num futuro próximo, estaremos voltando ao tema com muito mais sucessos a contar.