Terapia Gênica
Desordens genéticas acometem uma grande parte da população, uma vez que doenças como problemas cardiovasculares, diabetes, Alzheimer e câncer, dentre outras, possuem caráter gênico. Além destas, há as doenças monogênicas – causadas pela mutação ou alteração na sequência de DNA de um único gene –, sendo estas mais raras e, na maior parte dos casos, de difícil cura. Essas desordens são inatas ao DNA e, portanto, o mais natural é pensar que não há como reverter algo que está no DNA do indivíduo. Porém, a terapia gênica, promissora área de pesquisa, vem tentando reescrever o que está escrito no DNA de cada um de nós.
A terapia gênica nada mais é do que a introdução de um material genético que irá corrigir uma informação que está errada ou ausente no DNA do indivíduo, aliviando os sintomas ou até mesmo curando-o da desordem. No entanto, é extremamente raro que o material genético puro atravesse a membrana plasmática das células e, assim, é necessário encontrar formas para que o DNA chegue até as células alvo. Para tanto, é preciso um carreador, ou ”vetor”, que facilita a entrada de DNA nas células vivas.
Os vetores mais utilizados pela terapia gênica são os vírus. No entanto, para utilizá-los, é preciso modificá-los, de modo a retirar qualquer informação genética que possa desencadear uma resposta imune. Nessa modificação, apenas os genes essenciais para a constituição do vírus são mantidos. Além disso, o vetor deve ter especificidade, ou seja, caso o fígado seja o órgão da doença em pauta, o vetor deve ser capaz de entregar o gene às células do fígado, e não às do pâncreas, por exemplo. Muitos estudos são realizados buscando a construção de vetores melhores, justamente por este se tratar de um aspecto essencial de todo o processo.
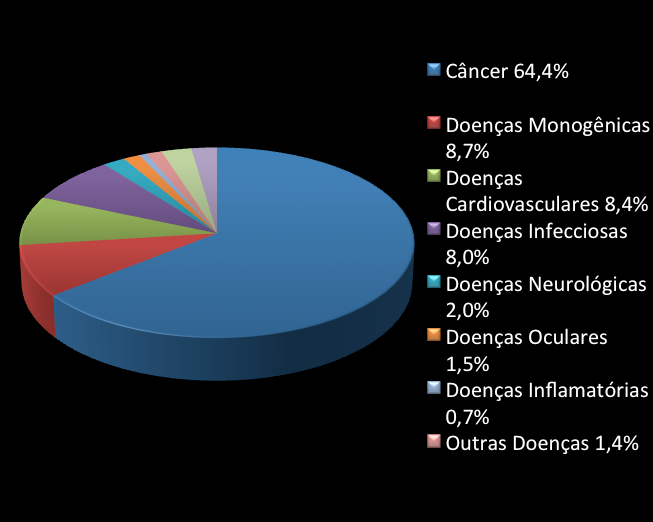 |
| Distribuição de testes clínicos com terapia gênica entre doenças variadas. |
Nesse contexto, um dos maiores desafios atuais em terapia gênica é a entrega do gene em células, tecidos, ou órgãos específicos. Além disso, não basta apenas introduzir um gene que irá efetuar mudanças na célula alvo, sua expressão também deve ser controlada, já que a expressão baixa pode não ter o efeito desejado e, de outro lado, a expressão descontrolada pode causar mais efeitos negativos do que positivos. Assim, muitos estudos também têm buscado formas de regular a expressão do gene terapêutico, para poder “ligá-lo” ou “desligá-lo” quando necessário. Para tanto, a introdução de substâncias exógenas tem sido uma das soluções com melhores resultados.
Em um exemplo, o sistema Tet-off, o gene é ligado quando na ausência do indutor e desligado em sua presença. Opostamente, no sistema Tet-on, o gene é ligado na presença do indutor e desligado em sua ausência. A criação desses sistemas de controle gênico é de extrema importância em terapia gênica, pois a introdução de um gene que não se consegue controlar pode resultar em sérios problemas. Um gene ligado à ativação de apoptose (forma específica de morte celular) para combate de tumores, por exemplo, pode acarretar uma morte celular desenfreada, causando problemas graves. Por isso, todos os processos, desde a escolha de qual gene utilizar, qual vetor, reações imunológicas e controle gênico, devem ser exaustivamente pesquisados, para que o tratamento não venha a ter o efeito inverso do desejado.
A pesquisa em terapia gênica já é bem disseminada pelo mundo, com cerca de 30 países contribuindo para o desenvolvimento de estudos clínicos, de vetores, imunológicos etc. Os Estados Unidos lideram o número de ensaios clínicos, com 65,1% dos estudos. Os países europeus representam 28,3%, com destaque para o Reino Unido, Alemanha, Franca e Suíça. O Brasil, no entanto, ainda inicia o desenvolvimento desse tipo de pesquisa, tendo pouca participação no cenário mundial. Em relação às doenças mais investigadas e com maior número de ensaios clínicos, o câncer é o líder. As doenças cardiovasculares também tem boa representatividade. Já as desordens monogênicas, que ocupam a segunda colocação em relação ao número de ensaios clínicos, possuem os maiores sucessos relatados na literatura.
Câncer
O fato do câncer ser a doença que recebe a maior atenção da terapia gênica não é uma surpresa, já que a doença se tornou uma das principais causas de morte em todo o mundo. Para essas pesquisas, o conhecimento biológico da doença é essencial, visando descobrir quais são os genes que estão diretamente ligados ao seu surgimento. Há certos genes, como o p53 e o Rb, que possuem alta relação com diversas formas de câncer, sendo, por isso, alvos óbvios para a terapia gênica. Outros genes, no entanto, são característicos de formas específicas de câncer. Estudos mostram que centenas de genes podem estar altamente expressos em células malignas e, por isso, há muito ainda a se estudar.
No caso do Rb, estudos mostraram que a transferência do gene pode induzir a apoptose em modelos de câncer de pescoço e bexiga. Nesse caso, o gene introduzido não é o selvagem (não mutado), mas uma forma modificada. Um outro gene é capaz de causar rupturas celulares em carcinomas ovarianos e células de glioma (tumores que acometem o sistema nervoso). Outros genes supressores, como o p14, mostraram-se capazes de induzir paralisação do ciclo celular e apoptose em uma variedade de tumores e também podem sensibilizar células à quimioterapia. Há genes que modificam a atividade angiogênica – de formação de vasos sanguíneos – no tumor, o que pode diminuir seu desenvolvimento ou até mesmo fazê-lo regredir, já que necessita dos nutrientes trazidos pelo sangue.
A imunoterapia – que procura estimular a resposta imunológica contra células cancerígenas – possui o maior número de protocolos na terapia gênica voltada para o câncer. As duas frentes em imunoterapia são a identificação de antígenos (partículas ou moléculas capazes de iniciar uma resposta imune) associados a tumores e o estudo da geração de respostas antitumorais pelas células dendríticas (células de defesa do organismo). Nesse sentido, um dos maiores avanços foi a clonagem de antígenos associados ao câncer em humanos, pois agora se sabe que células tumorais podem expressar antígenos e, portanto, que o sistema imune pode ser estimulado a combater o tumor. Porém, a imunoterapia apresenta um aspecto preocupante, já que o mesmo antígeno pode estar presente em outras células ou tecidos, que também passariam a ser, consequentemente, um alvo do sistema imune. Por isso, quanto mais específico o antígeno se mostrar em relação às células do câncer, melhor, e muitos estudos ainda devem ser realizados nessa área.
Doenças monogênicas
No caso das doenças monogênicas, caracterizada pela ausência ou deficiência de um dado gene, o objetivo da terapia é a transferência de um gene com funcionamento normal para as células alvo, uma vez que o gene restauraria a função deficiente encontrada no indivíduo pela transcrição do gene normal
A fibrose cística é a desordem monogênica mais comum na Europa e nos Estados Unidos, e seus portadores têm uma expectativa de vida menor que 40 anos, sendo por isso a doença monogênica mais estudada pela terapia gênica, com 22,4% dos ensaios clínicos. Há também sete desordens ligadas ao cromossomo X bem definidas, dentre elas a imunodeficiência severa combinada e a granulomatose crônica, que são as mais conhecidas e estudadas pela terapia gênica. Essas doenças ocorrem devido a mutações em genes relacionados ao sistema imune.
A síndrome da imunodeficiência severa combinada (SCID) corresponde a 20% dos ensaios clínicos em terapia gênica. A SCID é caracterizada pela ausência da imunidade mediada por células (linfócitos T) e humoral (devida aos anticorpos presentes no sangue), ausente, o que leva à morte na idade de 1 a 2 anos caso não haja transplante de medula óssea com sucesso. Por isso, são muito pesquisadas novas terapias para esse tipo de paciente, e a terapia gênica surge como uma possível solução, sendo a SCID provavelmente o caso mais bem sucedido em terapia gênica, com testes clínicos que resultaram na cura de 17 de 20 pacientes.
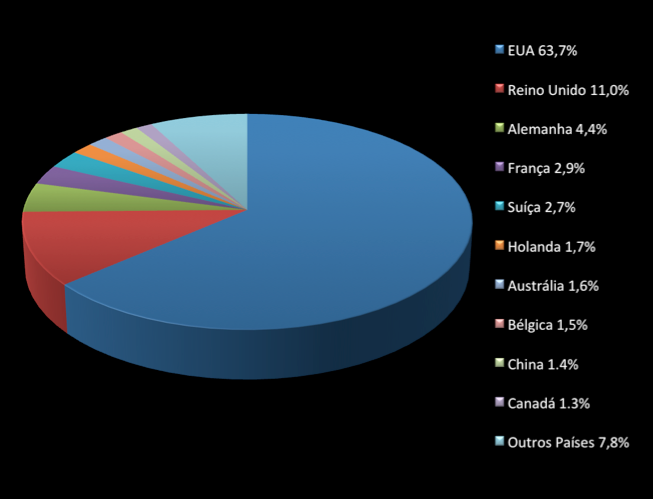 |
| Distribuição de testes clínicos com terapia gênica entre os países. |
Na hemofilia, a terapia gênica tem como objetivo introduzir o gene sadio (fator VIII ou fator IX, dependendo do tipo de hemofilia) nas células do paciente, para que este passe não apenas a produzir a proteína sadia necessária, mas que o faça em quantidade suficiente para restabelecer a saúde do paciente.
Riscos
Se, de um lado, a terapia gênica aparece como possibilidade de tratamento de doenças até hoje sem cura, ela também é considerada um procedimento de risco e, por isso, vários ensaios são realizados para testar sua segurança. A caracterização como procedimento de risco vem do fato de, muitas vezes, um vírus ser utilizado como vetor, além do próprio produto do gene, a proteína, poder ser entendido pelo organismo como um elemento estranho a ser combatido. Nesse contexto, muitos testes clínicos não obtiveram resultados satisfatórios, seja porque não foi possível detectar a proteína resultante do gene inserido ou porque a terapia não resultou nos efeitos esperados. Além disso, reações imunitárias desencadeadas pelo vetor, pelo DNA inserido ou pela proteína expressa são um grande problema e, para contorná-lo, os pesquisadores podem fazer uso de imunossupressores, para que a reação inicial seja interrompida e a terapia tenha tempo de agir sobre o organismo. Outra ameaça é que o vírus pode realizar inserções mutagênicas, levando ao desenvolvimento de leucemias, como ocorreu em testes clínicos em pacientes com SCID-X1 e granulomatose crônica.
Há também muitas questões éticas relacionadas à terapia gênica, já que ela modifica o que cada um é por natureza. Por isso, é necessário haver um controle sobre o que pode ou não ser alvo desse tipo de tratamento. Em geral, é mais aceita a terapia gênica quando se trata de doenças graves, que podem levar à morte dependendo do caso. Outras doenças, que levam o indivíduo a ser caracterizado como um ser “anormal socialmente”, como é o caso de doenças mentais, sofrem maior resistência. Por fim, também é necessário trazer à pauta o custo financeiro do desenvolvimento da terapia gênica, que é alto e, assim, poderá limitar a parcela da população com acesso ao tratamento. Em suma, é preciso continuar com os estudos, dando pequenos passos, respeitando os tempos necessários e garantindo todo o cuidado exigido.
Leituras sugeridas
- Samantha L. Ginn; Gene therapy clinical trials worldwide to 2012 – an update; THE JOURNAL OF GENE MEDICINE.
- S M Selkirk; Gene therapy in clinical medicine
- Arthur W. Nienhuis; Development of gene therapy for blood disorders; bloodjournal.hematologylibrary.org